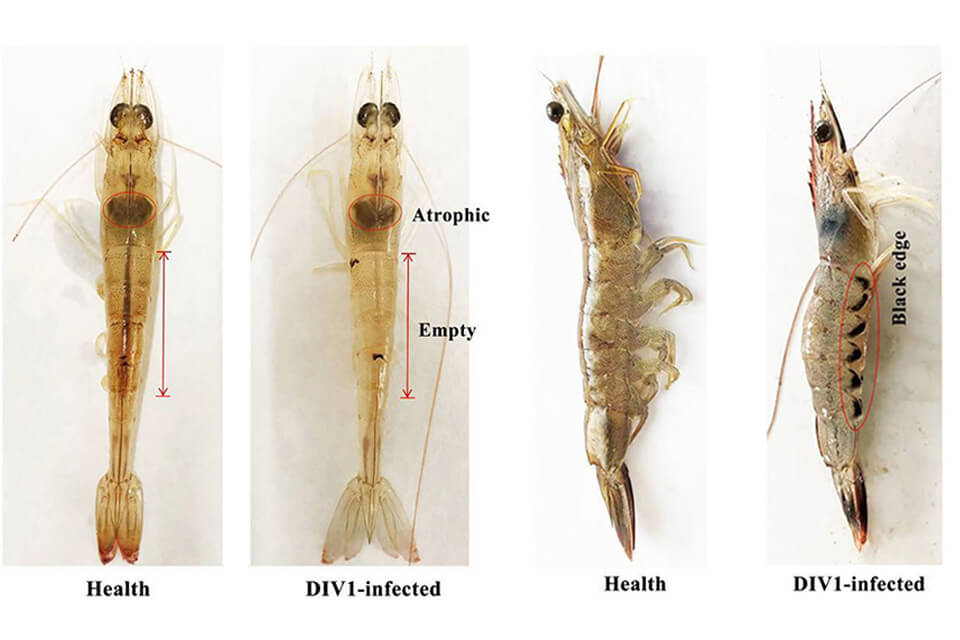
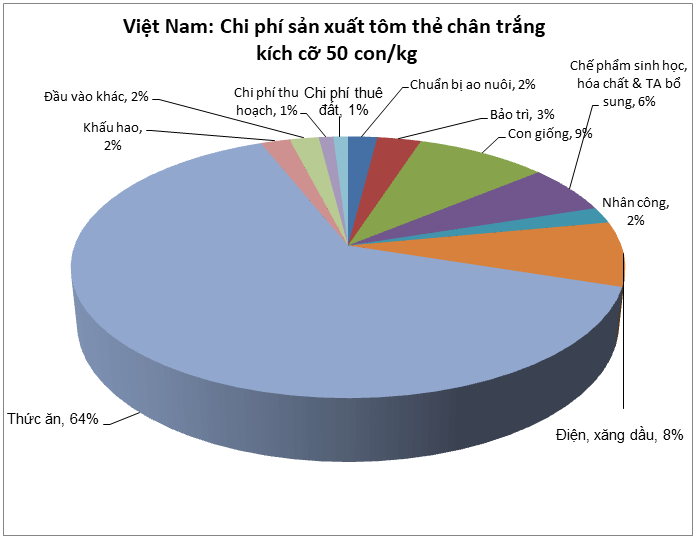
Thảo dược- Tổng quan và các ứng dụng trong nuôi trồng thủy sản
Giới thiệu

Thị trường thuốc thảo dược thế giới, bao gồm các sản phẩm thảo dược và nguyên liệu thô, được ước tính có tốc độ tăng trưởng hàng năm từ 5 đến 15%. Tổng thị trường thuốc thảo dược toàn cầu ước tính khoảng 62 tỷ USD và dự kiến sẽ tăng lên 5 nghìn tỷ USD vào năm 2050. Thị trường dược phẩm toàn cầu trị giá 550 tỷ USD năm 2004 (Maggon 2005) và dự kiến sẽ vượt 900 tỷ USD vào năm 2008. Ngành công nghiệp thảo dược chiếm khoảng 62 tỷ USD, có tiềm năng tăng trưởng tốt. Ngân hàng Thế giới báo cáo rằng thương mại cây thuốc, sản phẩm thuốc thực vật và nguyên liệu thô đang tăng trưởng với tốc độ hàng năm từ 5 đến 15% (Tổ chức Y tế Thế giới 2000). Trong cộng đồng châu Âu, thuốc thực vật chiếm một phần quan trọng trong thị trường dược phẩm (Bodekar và Kronenberg 2002); lĩnh vực dinh dưỡng cũng đang phát triển nhanh chóng. Năm 2001, ở Hoa Kỳ có 17,8 tỷ USD được chi cho thực phẩm bổ sung và 4,2 tỷ USD trong số đó được chi cho các phương pháp điều trị bằng thực vật (De Smet 2002). Ở Ấn Độ, giá trị thương mại liên quan đến thực vật là khoảng 10 tỷ USD mỗi năm với kim ngạch xuất khẩu hàng năm là 1,1 tỷ USD (Singh và cộng sự 2003), trong khi sản lượng thuốc thảo dược hàng năm của Trung Quốc trị giá 48 tỷ USD với xuất khẩu 3,6 USD. tỷ (Handa 2004). Hiện nay, Hoa Kỳ là thị trường lớn nhất của các sản phẩm thực vật của Ấn Độ, chiếm khoảng 50% tổng kim ngạch xuất khẩu. Nhật Bản, Hồng Kông, Hàn Quốc và Singapore là những nước nhập khẩu chính thuốc cổ truyền Trung Quốc, chiếm 66% thị phần xuất khẩu thuốc thực vật của Trung Quốc (Anon 2003).
Hormon, kháng sinh, vitamin và một số hóa chất khác đã được thử nghiệm như chất kích thích tăng trưởng, kháng khuẩn và các mục đích khác trong nuôi trồng hải sản (Jayaprakas và Sambhu 1996). Mặc dù các hóa chất trên có tác dụng tích cực đối với cá và tôm (Sambhu 1996), chúng không được khuyến khích sử dụng trong các hoạt động nuôi trồng hải sản thương mại do tác dụng tồn dư của chúng trong cơ của cá và tôm. Trong các trại sản xuất giống cá biển, việc sử dụng kháng sinh bừa bãi trong điều trị dự phòng đã dẫn đến sự phát triển của các chủng kháng thuốc và nhu cầu chuyển sang các loại kháng sinh khác (Brown 1989). Thuốc kháng sinh cũng có thể làm giảm sự phát triển của ấu trùng và ức chế cơ chế bảo vệ của ấu trùng cá. Nhiều loại thuốc kháng sinh và các loại thuốc tổng hợp khác đã cho thấy phản ứng mẫn cảm và các tác dụng phụ không mong muốn khác (Atal 1982).
Việc sử dụng kháng sinh trong các trại giống tôm đã dẫn đến hiện tượng tích tụ sinh học, từ đó dẫn đến việc tổng số lô hàng bị từ chối trong quá trình xuất khẩu. Cơ quan Phát triển Xuất khẩu Sản phẩm Thủy sản Ấn Độ (MPEDA) đã hướng dẫn các nhà điều hành trại giống và nông dân không sử dụng một số loại kháng sinh như chloramphenicol, nitrofurans bao gồm furazolidone, nitrofurazone, furaltadone, nitrofurantoin, furylfuramide, nifuratel, nifursoxime, nifurprazine và tất cả các dẫn xuất của chúng, và cả neomycin, axit nalidixic, sulphamethoxazole, và các chế phẩm của chúng, và chlorpromazine, colchicine, dapsone, dimetridazole, metronidazole, ronidazole, ipronidazole và các nitroimidazole khác, clenbuterol, diethylstilbestrol (DES), sulonamide (trừ sulfadimethoxine, sulfabromomethazine và sulfaethoxyrpyiadine đã được phê duyệt) và floroquinolones và glycopeptide hiện đang được sử dụng trong các trại sản xuất giống và trang trại (Sanandakumar 2002).
Ở cấp độ toàn cầu, mọi người đã hiểu tác hại của kháng sinh và hiện họ đang chuyển sang các sản phẩm tự nhiên (Fauci 1993). Từ trí tuệ cổ xưa, thảo dược đã được phát triển thành một phương pháp trị liệu bằng thực vật hiện đại mà độ an toàn, hiệu quả và ứng dụng của nó có thể được nắm vững. Điều này có nghĩa là một thế giới hoàn toàn mới với những lựa chọn điều trị chi phí thấp sẽ mở ra trước mắt chúng ta (Jones 1997). Thực vật là kho chứa và nguồn cung cấp các hóa chất an toàn hơn và rẻ hơn. Các chế phẩm thảo dược được kê toa để chữa các bệnh khác nhau vì chúng chứa các nguyên tắc hoạt động. Các chế phẩm thảo dược được biết là có vai trò quan trọng trong việc kiểm soát bệnh do hoạt động chống oxy hóa và kháng khuẩn của chúng (Prasad và Variyur Padhyoy 1993). Các sản phẩm thực vật tự nhiên đã được báo cáo là thúc đẩy các hoạt động khác nhau như chống căng thẳng, thúc đẩy tăng trưởng, kích thích sự thèm ăn, thuốc bổ và kích thích miễn dịch, đồng thời có đặc tính kích thích tình dục và kháng khuẩn trong nuôi cá và tôm do các nguyên tắc hoạt động như alkaloid, flavanoid, sắc tố, phenolics, terpenoid, steroid và tinh dầu (Citarasu và cộng sự 1998, 1999, 2001, 2002; Sivaram và cộng sự 2004).
Tầm quan trọng của giải pháp sử dụng thảo dược trong nuôi trồng thủy sản

Thuốc thảo dược đóng vai trò là chất kích thích tăng trưởng
Các sản phẩm thảo dược, ấu trùng Artemia giàu stressol-I- và stressol-II được nuôi bằng Penaeus indicus postarvae (PL 10–20) đã làm tăng đáng kể sự tăng trưởng và hiệu quả cũng như giảm áp lực thẩm thấu (Chitra 1995). Tefroli chứa các thành phần như Tephrosia purpurea, Eclipta alba, Phyllanthus niruri, Andrographis Panculata, Ocimum sanctum và Terminalia chebula được làm giàu bằng Artemia và cho tôm Penaeus monodon postlarvae (PL 20–50) ăn đã cải thiện hiệu quả sống sót, tăng trưởng và lột xác. Ngoài ra, Trasina, một sản phẩm thảo dược thương mại, làm giàu Artemia, được cho tôm giống P. monodon ăn đã cải thiện đáng kể hiệu quả tăng trưởng và stress (Rani 1999). Các sản phẩm thảo dược khác nhau như Hygrophila spinosa (Đình Lịch Gai), Withania somnifera (Sâm Ấn Độ), Zingiber officinalis (Gừng), Solanum trilobatum (Cà 3 Thùy), A. Paniculata (Xuyên Tâm Liên), Psoralea corylifolia (Bổ cốt Chi), Eclipta erecta (Cỏ Mực), Ocimum sacnctum (Hương Nhu Tía), P. niruri (Diệp Hạ Châu), Tinospora cordifolia (Thần Thông Dây), Silajit tinh khiết và dầu gan cá tuyết đều có những đặc điểm thúc đẩy tăng trưởng, chống căng thẳng, kích thích miễn dịch và chống vi khuẩn. Những chế phẩm này có ảnh hưởng tốt đến nghề nuôi ấu trùng Penaeus (Citarasu và cộng sự 1998, 2002). Livol (IHF-1000) là một loại thảo dược kích thích tăng trưởng thương mại đã được chứng minh là cải thiện đáng kể quá trình tiêu hóa, từ đó dẫn đến tăng trưởng, năng suất và sức khỏe tốt hơn ở các loài cá nuôi (Shadakshari 1993; Unnikrishnan 1995; Jayaprakas và Euphrasia 1996). Maheshappa (1993) đã nghiên cứu tác dụng của Livol (IHF-1000) đối với rohu, Labeo rohita và chế độ ăn kết hợp Livol đã kích thích hoạt động của enzyme tiêu hóa và dẫn đến tăng tiêu thụ. Bột lá đu đủ có chứa enzyme papain, có tác dụng làm tăng quá trình tiêu hóa protein, tỷ lệ chuyển đổi thức ăn, tốc độ tăng trưởng cụ thể và tăng trọng trong khẩu phần bột đu đủ không ngâm 16% được cho ăn ấu trùng P. monodon (Penaflorida 1995). Loại thảo dược nhân sâm trong khẩu phần ăn (Ginsana ® G115) đã nâng cao đáng kể hiệu suất tăng trưởng, hiệu quả sử dụng khẩu phần và các chỉ số huyết học ở cá rô phi sông Nile, Oreochromis niloticus, cá giống (Ashraf và Goda 2008). Quillaja saponin có khả năng làm tăng tốc độ tăng trưởng của các loài cá nuôi và làm giảm tốc độ trao đổi chất của chúng ở cá rô phi (Francis et al. 2005). Các chất kích thích tăng trưởng thảo dược giúp tạo ra tốc độ phiên mã. Quá trình này dẫn đến tăng RNA, tổng lượng axit amin và cuối cùng là tăng sản xuất protein trong tế bào.
Thuốc thảo dược hoạt động như chất kích thích miễn dịch
Chất kích thích miễn dịch là một loại hóa chất, thuốc, tác nhân gây căng thẳng hoặc tác dụng giúp tăng cường cơ chế phòng vệ hoặc phản ứng miễn dịch (Anderson 1992), do đó khiến động vật có khả năng kháng bệnh tốt hơn. Trong trường hợp dịch bệnh bùng phát theo chu kỳ và có thể dự đoán được, chất kích thích miễn dịch có thể được sử dụng để dự đoán các sự kiện nhằm nâng cao cơ chế phòng vệ không đặc hiệu và do đó ngăn ngừa tổn thất do bệnh tật. Tuy nhiên, cần thận trọng vì một số chất kích thích miễn dịch mạnh có thể ức chế hoặc thay đổi một số con đường sinh học nếu sử dụng không đúng cách.
Các tế bào máu tham gia vào quá trình tổng hợp, lưu trữ và sau khi kích hoạt giải phóng các pro-enzym và cơ chất của các dòng đông máu và proPO (Vargas-Albores và Yepiz-Plascencia 2000; Sritunyalucksana và Söderhäll 2000). Các protein của hệ thống proPO chiếm một vị trí rất nổi bật trong khả năng tự nhận biết, giao tiếp trong tế bào máu và sản xuất melanin. Sau khi kích hoạt và thoái hóa tế bào máu, proPO không hoạt động sẽ được chuyển đổi thành phenoloxidase hoạt động (PO) nhờ enzyme kích hoạt prophenoloxidase (ppA). Enzim PO xúc tác quá trình oxy hóa từng bước phenol thành quinone, sau đó là một số bước trung gian dẫn đến sự hình thành melanin.
Glycyrrhizin là một saponin được glycosyl hóa, chứa một phân tử axit glycyrretinic, có hoạt tính chống viêm và chống khối u, qua trung gian là các hoạt động điều hòa miễn dịch của nó (Wada et al. 1987; Zhang et al. 1990). Edahiro và cộng sự. (1991) báo cáo rằng cá đuôi vàng được điều trị bằng đường uống bằng glycyrrhizin cho thấy khả năng bảo vệ tăng lên chống lại nhiễm trùng E. seriola, mặc dù hoạt động lysozyme trong máu và hoạt động thực bào của đại thực bào không được tăng cường. Tuy nhiên, Kim và cộng sự (1998) báo cáo rằng điều trị in vitro bằng glycyrrhizine đã tăng cường hoạt động hô hấp của đại thực bào và phản ứng tăng sinh của tế bào lympho từ cá hồi vân. Cá hồi vân được điều trị bằng đường uống bằng protein đậu nành cho thấy các hoạt động bạch cầu tăng lên như thực bào, tiêu diệt vi khuẩn và sản xuất superoxide. Việc sử dụng saponin Quil A trong bồn tắm với vắc-xin Yersinia ruckeri đã tăng cường hoạt động diệt khuẩn trong ống nghiệm ở cá hồi vân (Grayson và cộng sự 1987). Ninomiya và cộng sự (1995) đã báo cáo rằng việc sử dụng saponin Quil A bằng đường uống làm tăng sự di chuyển bạch cầu ở cá đuôi vàng. Tác dụng kích thích miễn dịch của polysacarit gắn với protein PS-K. Spiralina, các phân đoạn axit peptide từ quá trình thủy phân protein cá cũng được báo cáo ở cá rô phi, O. Niloticus bởi Park và Jeong (1996), cá da trơn của Duncan và Klesius (1996) và cá hồi Đại Tây Dương của Gildberg et al. (1996), tương ứng. Ngoài ra, các chất kích thích miễn dịch thảo dược Emblica officinalis, Cynodon dactylon và Adathoda vasica đã cải thiện hệ thống miễn dịch và giảm nhiễm trùng vi khuẩn ở cá vàng Carassius auratus (Minomol 2005), và nghiên cứu tương tự đã được thực hiện bởi Magdelin (2005) trên cá cảnh Poecilia sphenops sử dụng thảo dược. chất kích thích miễn dịch. Chiết xuất metanol của các loại thảo dược O. sanctum, W. somnifera và Myristica Fragrans đã cải thiện đáng kể các thông số miễn dịch như hoạt động thực bào, hoạt động diệt khuẩn trong huyết thanh, tỷ lệ albumin-globulin (A/G) và leukocrit chống lại thách thức Vibrio harveyi ở cá mú non, Epinephelus tauvina, nuôi ấu trùng (Sivaram et al. 2004). Ngoài ra, chiết xuất metanol của năm loại cây thuốc thảo dược khác nhau là C. dactylon, Aegle marmelos, T. cordifolia, P. kurooa và E. alba, đã được lựa chọn và chế biến làm thức ăn cho tôm nhiễm WSSV. Các nồng độ khác nhau, tức là chế độ ăn 100, 200, 400 và 800 mg/kg -1 có ảnh hưởng tích cực và đáng kể là có khả năng sống sót tốt hơn (74%) và giảm tải lượng virus. Ngoài ra, hiệu suất tốt hơn của các thông số huyết học, sinh hóa và miễn dịch đã được tìm thấy trong chế độ ăn kết hợp chất kích thích hệ miễn dịch cho tôm (Citarasu et al. 2006). Các hợp chất thảo dược có khả năng ức chế sự hình thành các anion oxy và loại bỏ các gốc tự do. Tác dụng chống oxy hóa từ thảo dược đã được chứng minh là tương tự như tác dụng của superoxide effutase, chất thải ion kim loại và chất ức chế xanthine oxyase. Ví dụ điển hình nhất là loại thảo dược Picrorhiza kurroa được sử dụng làm hợp chất chống stress cho tôm (Citarasu và cộng sự 1998). Ngoài ra, O. sanctum còn có ảnh hưởng tích cực đến tác dụng kích thích miễn dịch ở Oreochromis rêuambicus chống lại nhiễm trùng Aeromonas hydrophila. Việc tiêu thụ O. sanctum trong chế độ ăn cũng giúp tăng cường phản ứng kháng thể và khả năng kháng bệnh chống lại A. hydrophila (Logambal et al. 2000).
Thuốc thảo dược đóng vai trò là chất kháng khuẩn
Trong hầu hết các trường hợp, phenolics, polysaccharides, proteoglycan và flavonoid đóng vai trò chính trong việc ngăn ngừa hoặc kiểm soát vi khuẩn truyền nhiễm. Citarasu và các đồng nghiệp (Citarasu 2000; Citarasu et al. 2003a, b) phát hiện ra rằng hậu ấu trùng P. monodon (PL 1–25) được nuôi trong nước cấy vi khuẩn cho thấy lượng Vibrio tăng lên (3,76 × 10 5 CFU g −1) trong các bộ phận mô. Đồng thời, các chất chiết xuất từ thảo mộc có chứa metanol như Artemia S. trilobatum, A. Paniculata và P. corylifolia đã giúp giảm lượng Vibrio ở mức 1,27 × 10 5, 1,12 × 10 4 và 1,12 × 10 5 CFU g −1, tương ứng, trong các mô hậu ấu trùng P. monodon. Mức tải lượng vi khuẩn tương tự cũng được phản ánh trong quá trình tiêm chủng P. aeruginosa, S. Ureus và S. typhi. Immanuel và cộng sự (2004) đã nghiên cứu lượng vi khuẩn trên tôm con P. indicus được nuôi bằng rong biển và chiết xuất thảo dược và nuôi trong môi trường nuôi cấy Vibrio parahaemolyticus. Có một lượng vi khuẩn lớn (3,71 và 3,86 × 10 5 CFU g −1 trong các mô cơ và gan tụy) được quan sát thấy khi cho tôm con ăn Artemia không được tăng cường dinh dưỡng. Điều thú vị là, khi cho các nhóm ăn Artemia giàu thảo dược và rong biển, lượng vi khuẩn đã giảm đi rất nhiều. Khi so sánh với các chế độ ăn này, Ricinus communis được cho ăn theo nhóm có kết quả tốt hơn các chế độ ăn khác (1,36 × 10 5 CFU g −1 ở mô cơ và 1,47 × 10 5 CFU g −1 ở mô gan tụy). Đồng thời, các khẩu phần khác sử dụng Artemia giàu dinh dưỡng cho các nhóm có tải lượng vi khuẩn lần lượt là 1,48 và 1,66 × 10 5 CFU g −1 ở P. niruri, 2,03 và 2,03 và 2,16 × 10 5 CFU g −1 ở L. aspera (T3), 1,54 và 1,75 × 10 5 CFU g −1 ở M. esculenta, 1,70 và 1,89 × 10 5 CFU g −1 ở U. lactuca và 1,84 và 1,96 × 10 5 CFU g −1 ở S. wightii trong cơ và mô gan tụy tương ứng. Praseetha (2005) đã kiểm soát thành công các mầm bệnh trên tôm như V. parahaemolyticus và V. damsela bằng chiết xuất butanolic của W. somnifera thông qua việc làm giàu Artemia. Ngoài ra, các chất kích thích miễn dịch thảo dược E. officinalis, C. dactylon và A. vasica đã cải thiện hệ thống miễn dịch và giảm nhiễm trùng vi khuẩn ở cá vàng C. auratus. Ngoài ra, các loại thảo mộc này còn đóng vai trò là chất ức chế con đường cảm nhận tối thiểu ở Vibrio sp. và Pseudomonas sp. mầm bệnh. Shangliang (1990) đã báo cáo hoạt động kháng khuẩn của năm chiết xuất thảo dược Trung Quốc, Stellaria Aquas, Impatiens biflora, Oenothera biennis, Artemisia Vulgaris và Lonicera japonica, chống lại 13 loại vi khuẩn gây bệnh trên cá. Aeromonas salmonicida và Edwardsiella ictaluri nhạy cảm nhất với các chất chiết xuất này. Trong số đó, S. Aquas có hiệu quả nhất cả về số lượng mầm bệnh bị ức chế cũng như mức độ ức chế. Ví dụ, tỏi hoặc hành tây đã được trộn thành dạng viên để cho tôm ăn hàng ngày nhằm ngăn ngừa nhiễm khuẩn. Một nghiên cứu khoa học chứng minh hoạt tính kháng khuẩn của ổi (Psidium guajava) chống lại vi khuẩn gây bệnh cho tôm được bắt đầu vào năm 1992. Nồng độ ức chế tối thiểu của ổi đối với Vibrio và A. hydrophila lần lượt là 1,25 và 0,625 mg ml -1. Họ phát hiện ra rằng ổi loại bỏ vi khuẩn phát sáng ở tôm sú (P. monodon) hiệu quả hơn so với oxytetracycline (Direkbusarakom 2004). Chiết xuất ethanol, metanol và hexane từ Ocimum basilicum đã được nghiên cứu về đặc tính kháng khuẩn in vitro chống lại 146 vi sinh vật bao gồm cả mầm bệnh nuôi trồng thủy sản. Chiết xuất hexane cho thấy phổ hoạt động kháng khuẩn mạnh hơn và rộng hơn (Adigüzel và cộng sự 2005). Chiết xuất hạnh nhân Ấn Độ, Terminalia catappa, là một phương pháp kháng khuẩn thay thế chống lại ký sinh trùng cá rô phi và mầm bệnh vi khuẩn A. hydrophila. Sự phát triển của hai chủng A. hydrophila bị ức chế ở nồng độ 0,5 mg ml -1 (Chitmanat et al. 2005). Các nguyên tắc hoạt động kháng khuẩn của thảo dược có thể làm ly giải thành tế bào, ngăn chặn quá trình tổng hợp protein và tổng hợp DNA, ức chế sự tiết enzyme và cản trở cơ chế truyền tín hiệu của con đường cảm nhận đại biểu.
Thuốc thảo dược hoạt động như thuốc chống vi-rút
Nhiều loại thảo mộc đã được sử dụng trong nhiều thiên niên kỷ như các biện pháp chữa trị tại nhà và một số loại thảo dược này có đặc tính kháng virus mạnh. Một số ít đã được phát hiện là có hoạt tính kháng virus chống lại virus cá trong nuôi cấy mô (Direkbusarakom et al. 1996a), và một số đã được nghiên cứu về khả năng cũng như tác động của chúng đối với virus lây nhiễm và giết chết tôm (Direkbusarakom et al. 1995). Direkbusarakom và cộng sự. (1996b) đã thử nghiệm khả năng của chiết xuất ethanol tạo phức với polyvinylpyrolidone từ Clinacanthus nutans được cho tôm ăn để cung cấp cho tôm khả năng kháng virus đầu vàng. Ba mức chiết xuất được cho các nhóm tôm sú (15–20 g) ăn ba lần trong 7 ngày. Sau 7 ngày, tôm tiếp xúc với YHV qua đường nước. Tôm sống sót hơn 95% trong khi đối chứng chỉ sống sót 25%. Một nhóm thảo mộc khác đã được xem xét là Phyllanthus spp. Direkbusarakom và cộng sự. (1995) đã kiểm tra khả năng tác động của chiết xuất phức hợp PVP của ethanol đến YHV. YHV được trộn với 10 mg chiết xuất thảo mộc và tiêm vào tôm. Vật liệu chiết xuất này đã làm bất hoạt virus và khiến virus không có khả năng gây bệnh. Nhưng làm thế nào điều này sẽ chuyển thành lợi ích trong lĩnh vực này vẫn chưa rõ ràng. Có lẽ nguyên liệu trong thức ăn hoặc trong máu sẽ làm bất hoạt virus nhiều như đã thấy với Fucoidan. Ngoài ra, chiết xuất metanol của năm loại cây thuốc thảo dược khác nhau như C. dactylon, A. marmelos, T. cordifolia, P. kurooa và E. alba đã được lựa chọn và chế biến làm thức ăn cho tôm nhiễm WSSV. Các nồng độ khác nhau, tức là chế độ ăn 100, 200, 400 và 800 mg/kg, bị ảnh hưởng tích cực và đáng kể là có khả năng sống sót tốt hơn (74%) và giảm tải lượng virus. Ngoài ra, hiệu suất tốt hơn của các thông số huyết học, sinh hóa và miễn dịch đã được tìm thấy trong chế độ ăn kết hợp chất kích thích miễn dịch cho tôm (Citarasu et al. 2006). Micol và cộng sự. (2005) đã kiểm soát thành công rhabdovirus salmonid, virus nhiễm trùng máu xuất huyết (VHSV), bằng chiết xuất thực vật có nguồn gốc từ lá cây ô liu (Olea europaea) và hợp chất chính của nó, oleuropein (Ole). Chiết xuất metanol của các loại thảo dược Aclypha indica, C. dactylon, P. kurooa, W. somnifera và Z. officinalis đã ức chế WSSV một cách hiệu quả sau khi tiêm chiết xuất thảo dược và hỗn hợp ủ WSSV (Yogeeswaran 2007). Tôm được xử lý bằng thảo dược vẫn sống sót. 60% sau 20 ngày thử thách, trong khi đối chứng chết trong vòng 4 ngày với tỷ lệ tử vong 100%. Hai mươi loài cây thuốc truyền thống Ấn Độ nhưA. marmelos, C. dactylon, L. camara, M. charantia và P. amarus cho thấy hoạt tính kháng virus mạnh chống lại WSSV dưới dạng chiết xuất ete dầu mỏ, benzen, dietyl ete, chloroform, etyl axetat, metanol và etanol. Trong số các loài thực vật, dịch chiết nước của C. dactylon cho thấy hoạt tính kháng virus mạnh ở nồng độ 100 mg/kg cơ thể động vật (Balasubramanian et al. 2007). Các hợp chất hoạt tính thảo dược có thể ức chế hoặc ngăn chặn quá trình phiên mã của virus để làm giảm sự nhân lên trong tế bào vật chủ và tăng cường khả năng miễn dịch không đặc hiệu. Chúng hoạt động như chất kích thích miễn dịch đối với hệ thống miễn dịch của vật chủ.
Thuốc thảo dược hoạt động như chất chống căng thẳng
Các hợp chất thảo dược có khả năng ức chế sự hình thành các anion oxy và loại bỏ các gốc tự do. Tác dụng chống oxy hóa từ thảo dược đã được chứng minh là tương tự như tác dụng của superoxide effutase, chất thải ion kim loại và chất ức chế xanthine oxyase. Ví dụ điển hình nhất là loại thảo mộc P. kurroa được sử dụng làm hợp chất chống stress cho tôm (Citarasu và cộng sự 1998). Tác dụng bảo vệ gan của P. kurroa chưa được hiểu đầy đủ nhưng có thể là do khả năng của Picrorhiza trong việc ức chế sự tạo ra các anion oxy và loại bỏ các gốc tự do. (Russo và cộng sự 2001) Tác dụng chống oxy hóa của Picrorhiza đã được chứng minh là tương tự như tác dụng của superoxide effutase, chất thải ion kim loại và chất ức chế xanthine oxyase. (Chander và cộng sự 1992) Ở chuột bị nhiễm bệnh sốt rét, Picrorhiza đã phục hồi mức glutathione đã cạn kiệt, từ đó tăng cường giải độc và chống oxy hóa, đồng thời giúp duy trì sự cân bằng oxy hóa-khử bình thường. Trong cùng mô hình động vật này, Picrorhiza cũng đã chứng minh tác dụng chống peroxid hóa lipid (Chander và cộng sự 1998). Các sản phẩm Stresstol (W. somnifera, O. sanctum, Silajit tinh khiết, T. cordifolia, Picrorrhiza kurvooa, E. erecta, Ipomea Digitata, Vernonia cinera) và Tefroli (T. purpurea, E. alba, P. niruri, A. Paniculata, O. sanctum và T. chebula) có ảnh hưởng tốt đến hậu ấu trùng tôm. Hậu ấu trùng được nuôi bằng các sản phẩm trên có khả năng chống lại áp suất thẩm thấu, nhiệt độ và pH (Citarasu et al. 1998; Rani 1999). Rutin là một bioflavonoid được chiết xuất từ Toona sinensis có hoạt tính chống oxy hóa và chống stress mạnh ở động vật giáp xác. Rutin đã cải thiện các thông số sinh hóa, miễn dịch và huyết học ở tôm thẻ chân trắng Litopenaeus vannamei trong điều kiện stress do Vibrio alginolyticus (Hsieh et al. 2008). Các chất chiết xuất từ thảo dược, Astragalus membranaceus, Portulaca oleracea, Flavescent sophora và A. Paniculata, hoạt động như một chất chống căng thẳng và tạo ra các thông số miễn dịch như hoạt động của lysozyme trong huyết thanh, SOD, NOS và hàm lượng protein huyết thanh tổng số, globulin và albumin ở cá chép Cyprinus (Wu và cộng sự 2007). Tác dụng của hai loại dược liệu Trung Quốc (A. membranaceus và L. japonica) đã cải thiện phản ứng miễn dịch không đặc hiệu của cá rô phi sông Nile (O. niloticus) chống lại nhiễm trùng A. hydrophila được nghiên cứu bởi Ardó et al. (2008).
Thuốc thảo dược có tác dụng kích thích sự thèm ăn
Nhiều chiết xuất thực vật khác nhau từ các loại thảo mộc và gia vị đã được báo cáo là cải thiện năng suất vật nuôi bằng cách kích thích hoạt động bài tiết đường ruột hoặc có tác dụng diệt khuẩn trực tiếp lên hệ vi sinh đường ruột. Việc sử dụng các loại gia vị cay từ ớt (ví dụ capsaicin và piperine) và các loại tinh dầu khác (ví dụ như quế) cung cấp cinnamaldehyde đã được chứng minh là có tác dụng kích thích tiết nước bọt (sản xuất amylase). Sự gia tăng sản xuất enzyme có thể dẫn đến cải thiện khả năng tiêu hóa và khả năng cung cấp chất dinh dưỡng từ thức ăn chăn nuôi (Chesson 1987). Việc giảm lượng chất chưa tiêu hóa đi vào ruột già sẽ hạn chế lượng chất nền có sẵn cho sự phát triển của vi khuẩn gây bệnh. Các hoạt chất thảo mộc/gia vị trong khẩu phần ăn có tác dụng kích thích tiết enzym tiêu hóa. Nó sẽ dẫn đến việc kích thích sự thèm ăn và tăng mức tiêu thụ thực phẩm và hiệu quả. Các loại thảo dược đặc trưng thúc đẩy tăng trưởng tạo ra sự phiên mã và dẫn đến tổng hợp protein cao.
Livol (IHF-1000) là chất kích thích tăng trưởng thảo dược có chứa các thành phần thực vật khác nhau như Bohaevia diffusa, Solanum nigrum, Terminaelia arjuna, Colosynth và muối đen và đã được chứng minh là cải thiện đáng kể quá trình tiêu hóa, từ đó dẫn đến tăng trưởng, năng suất và sức khỏe tốt hơn ở cây trồng. cá (De Bolle và cộng sự 1996; Shadakshari 1993; Unnikrishnan 1995 ; Jayaprakas và Euphrasia 1996). Maheshappa (1993) đã nghiên cứu tác dụng của Livol (IHF-1000) đối với rohu, L. rohita, chế độ ăn kết hợp Livol đã kích thích hoạt động của enzyme tiêu hóa và dẫn đến tăng tiêu thụ. Bột lá đu đủ có chứa một loại enzyme là papain có tác dụng làm tăng quá trình tiêu hóa protein, tỷ lệ chuyển đổi thức ăn, tốc độ tăng trưởng cụ thể và tăng trọng trong khẩu phần bột đu đủ không ngâm 16% cho P. monodon postlarvae (Penaflorida 1995). Hậu ấu trùng P. monodon được cho ăn với các tỷ lệ khác nhau (0, 25, 50, 75 và 100%) thức ăn khai vị thảo dược Z. officinalis làm giàu Artemia. Sau 30 ngày nuôi cấy, kết quả rất khả quan đã được tìm thấy ở hậu ấu trùng được nuôi bằng Artemia được làm giàu bằng Z. officinalis. Có sự cải thiện đáng kể (P < 0,05) về hoạt động của enzyme tiêu hóa (amylase, protease và lipase), FCR cao, lượng ăn vào và hiệu quả chuyển đổi và sản xuất (Venketramalingam et al. 2007).

Phần kết luận
Các hoạt chất thảo dược y sinh học trong nuôi tôm có đặc tính kích thích tăng trưởng, bồi bổ hệ miễn dịch, kháng khuẩn, kích thích ăn ngon và đặc tính chống stress do có các đặc tính hoạt chất như alkaloid, flavanoid, sắc tố, phenolics, terpenoid, tinh bột, steroid và tinh dầu sẽ được sử dụng rất nhiều trong nuôi tôm. Cách thực hành này sẽ làm giảm tác dụng phụ của việc áp dụng các hợp chất tổng hợp và chi phí, đồng thời làm cho nó trở nên thân thiện với môi trường. Do đó, các loại thuốc sinh học thảo dược thay thế tỏ ra rất hiệu quả trong hoạt động nuôi trồng thủy sản.
Nguồn tham khảo: https://link.springer.com/article/10.1007/s10499-009-9253-7#article-info
Aquaculture International (Journal of the European Aquaculture Society)